낙타 항체로 부터 개발된 Nanobody (Variable heavy chain domains of heavy chain, VHH)
흔히 nanobody(나노바디) 라고 하는 것은 벨기에의 Ablynx 사 (Sanofi 사에 인수됨)가 걸어놓은 상표명입니다. 상업적으로는 nanobody 라고 쓸 수 없습니다. 마치 일반명사처럼 되어 버려서 학계에서 또는 논문에서도 nanobody 라고 칭하기도 하지만 엄밀히 말하면 이는 상표라고 합니다. 대신 VHH 라고 써야 맞는 것이죠.
VHH, nanobody 의 학술용어
VHH는 "Variable heavy chain domains of heavy chain"의 약자입니다. 이는 낙타류나 상어의 항체에서 발견되는 단일 도메인 항체(single-domain antibody, sdAb)로 이루어진 구조를 말합니다. VHH의 H가 두 번 들어가는 이유는, 일반적인 항체는 가벼운 사슬(Light chain, L)과 무거운 사슬(Heavy chain, H)의 구조를 가지지만, VHH는 가벼운 사슬 없이 오직 무거운 사슬의 가변영역(Variable domain)이 존재하기 때문입니다. 첫 번째 H는 무거운 사슬(Heavy chain)을, 두 번째 H는 무거운 사슬 내부의 가변영역(Heavy chain's Variable region)을 의미합니다.
ABLYNX, nanobody 개념 originator 이자 nanobody 상표권자
1993년에 light chain 없는 항체를 처음 보고한 이후 (https://doi.org/10.1038/363446a0 ) 이 사이언스를 기반으로 벨기에의 Ablynx가 설립되었습니다. Vlaams Instituut voor Biotechnologie (VIB) and the Free University of Brussels (VUB)의 스핀오프한 회사인데요, 2001년 설립되었습니다. 그리고 Nanobody라는 명칭을 만들었죠. 상표도 등록하고요. 그러고 난후 2017년에 좀 쎈 논문을 냈습니다. ( Ablynx's nanobody fragments go places antibodies cannot. Nat Biotechnol 35, 1115–1117 (2017). https://doi.org/10.1038/nbt1217-1115 )지켜보던 노보노디스크가 인수를 제안했지만 너무 저렴하다며( $3.1 billion ) 거절하고, 2018년에 사노피가 제안한 $4.8 billion 은 수용하고 인수되었습니다.
구조의 차이: scFV vs. VHH (nanobody)


노란 색의 인간 단클론 항체는 150 kD 입니다. Fab 부분이 경쇄까지 달려있기 때문에 무겁습니다. 항원을 인식하는 부위 또한 중쇄와 경쇄가 각 CDR1,2,3 를 가지고 같이 잡아야 합니다. 이 항원을 잡는 부위 (PARATOPE) 는 경쇄와 중쇄가 같이 붙어야 하는데, 이들은 서로 소수성 상호작용으로 연결합니다. 이 부분을 잘라내 scFV 라는 작은 조각으로 잘라 씁니다. 얘들은 30kDa 정도입니다.

그러나 낙타 항체는 일단 Fab 부위에 경쇄가 없습니다. 전체적으로 거의 반값정도의 분자량을 가집니다. 75kDa 밖에 안 됩니다. 항원결합도 중쇄의 CDR1,CDR2, CDR3 만으로 감당해야 하니, 그래서 CDR 3 가 좀 더 길게 진화된 것일 수도 있겠습니다. 이 3번째 CDR 은 마치 손가락처럼 길기 때문에 항원의 미세한 구멍 같은 곳까지 파고들어가 꽉 잡을 수 있고 또 이 긴 길이를 자유자재로 다양한 서열로 구성할 수 있기 때문에 좀 더 specific 한 결합이 가능해 질 수 있습니다 (diversity of paratope). 분량은 scFV 의 반값, 약 15kDa 으로 아주 가볍습니다.


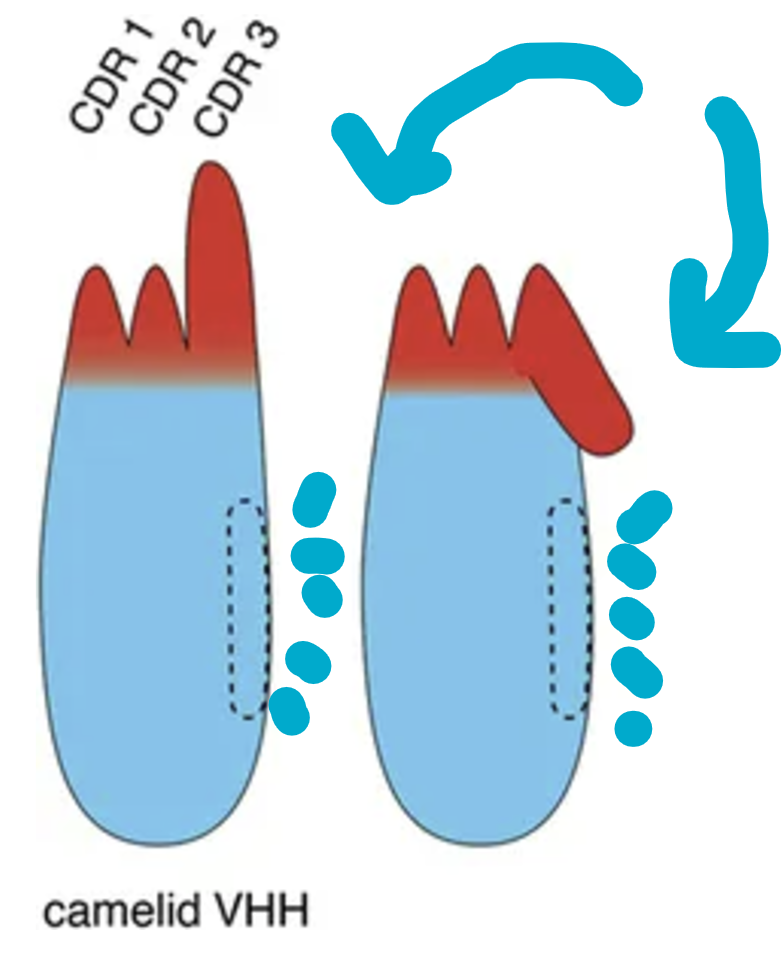
게다가 scFV 는 경쇄 중쇄가 서로 붙어 있어야 하므로, 소수성 부위가 있습니다(왼쪽 그림 까만 부위).
VHH, nanobody 의 특징 (장점?): 작음
반면 낙타항체의 VHH 부분은 소수성 부분이 없습니다. 혼자서도 충분히 일할 수 있기 때문에 누구랑 손잡을 필요가 없으니까요. 혈액에서 조직에서 자유로이 다닐 수 있도록 표면이 모두 친수성입니다.
이 나노바디는 상당히 안정적이라고 알려져 있습니다. 작기 때문에 일반 항체보다 종양 침투가 더 잘되고, 생산 비용 또한 낮을 수 있습니다. 꼭 CHO cell 에서 생산하지 않고 박테리아 기반으로 생산할 수도 있기 때문입니다다. 물론 치료제로 쓰기 위해서는 면역원성을 해결해야 하므로, CDR 부분만 이용하고 인간화 하여 활용해야 합니다.
작기 때문에 종양 침투율이 좋긴 하지만 동시에 신장에서 빨리 제거됩니다. 이미징 용으로 쓸 때는 좋은 점입니다. 이미징을 위해 동위원소를 달았다면 웬만하면 체내에서 빨리 없어지는 것이 좋으니까요. 하지만 치료제의 경우에는 체내에 오래 머물러야 좋기 때문에, Fc 를 달아 보완하는 방법도 있지만, 젤로퓨신(gelofusine)과 라이신(lysine) 등으로 이를 보완할 수 있다고 합니다. 젤로퓨신(gelofusine)과 라이신(lysine) 은 나노바디의 신장 배설 문제를 해결하기 위해 사용되는 물질로써, 나노바디가 체내에서 더 오랫동안 머물 수 있도록 도와주므로 임상효능 개선에 사용될 수 있습니다.
또한 작기 때문에 세포 안쪽으로도 항체보다 더 용이하게 들어갈 수 있다고 합니다. 세포막은 일반적으로 지질 이중층이므로 친수성 분자가 그 자체로는 침투하기 어렵습니다. 나노바디가 세포 안으로 들어가는 것은 저분자 약물처럼 diffuse 해서 들어가는 것은 아닙니다. 첫번째 전략은 일단 일정 수용체를 일단 잡아야 하고, 이것이 첫번째 타겟이 될 것입니다. 이 수용체 결합과정에서 세포내로 들어간 후, 세포 내의 타겟을 잡습니다. 따라서 이럴 때에는 나노바디가 특정 수용체에 결합하면서 동시에 세포 내의 타겟에 결합해야 합니다. 즉 이중 표적을 가져야 합니다. 이때는 서로 다른 항원을 타게팅 하는 서로 다른 나노바디 2분자를 연결해야 합니다(바이스페시픽, bispecific nanobody).
기타 두번째 전략은 tumor penetrating peptides (TPPs) 를 사용하는 것이 알려져 있고, 또한 그 자체로 세포 내로 들어가는 것도 개발되고 있습니다(Intrabody).